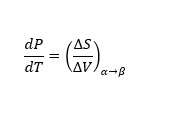Equilibrio De Fases y Diagramas De Fases
EL EQUILIBRIO DE FASES ES EL ESTUDIO DEL EQUILIBRIO QUE EXISTE ENTRE O EN LOS DIFERENTES ESTADOS DE MATERIA; ES DECIR SÓLIDO, LÍQUIDO Y GAS. EL EQUILIBRIO SE DEFINE COMO UNA ETAPA CUANDO EL POTENCIAL QUÍMICO DE CUALQUIER COMPONENTE PRESENTE EN EL SISTEMA PERMANECE ESTABLE CON EL TIEMPO. LA FASE ES UNA REGIÓN EN LA QUE LA INTERACCIÓN INTERMOLECULAR ES ESPACIALMENTE UNIFORME O EN OTRAS PALABRAS LAS PROPIEDADES FÍSICAS Y QUÍMICAS DEL SISTEMA SON IGUALES EN TODA LA REGIÓN. DENTRO DEL MISMO ESTADO, UN COMPONENTE PUEDE EXISTIR EN DOS FASES DIFERENTES, COMO LOS ALÓTROPOS DE UN ELEMENTO. ADEMÁS, DOS COMPUESTOS INMISCIBLES EN EL MISMO ESTADO LÍQUIDO PUEDEN COEXISTAR EN DOS FASES.
El equilibrio de fases tiene una amplia gama de aplicaciones en industrias que incluyen la producción de diferentes alótropos de carbono, la reducción del punto de congelación del agua mediante la disolución de sal (salmuera), la purificación de componentes por destilación, el uso de emulsiones en la producción de alimentos, la industria farmacéutica, etc. El equilibrio sólido-sólido ocupa un lugar especial en la metalurgia y se utiliza para hacer aleaciones de diferentes propiedades físicas y químicas. Por ejemplo, el punto de fusión de las aleaciones del cobre y la plata es más bajo que el punto de fusión del cobre o de la plata.
Para colmo, el sector aeroespacial utiliza el equilibrio de fases para mejorar la estabilidad y el rendimiento de los propulsores y combustibles de cohetes. No solo eso, mejoró la eficiencia y durabilidad de materiales avanzados para mejorar su durabilidad y eficiencia y hacerlos óptimos para su uso en las industrias de la construcción y la energía.
Diagramas de fase
Los diagramas de fase se utilizan para comprender la relación entre las diferentes fases y generalmente se representan como el cambio en la fase de un sistema en función de la temperatura, la presión o la composición de los componentes de un sistema. El sistema existe en una fase donde la energía libre de Gibbs del sistema es menor. En equilibrio, la temperatura, la presión y el potencial químico de las moléculas del componente constitutivo en el sistema deben ser iguales en todas las fases. La figura 1 muestra un esquema general del diagrama de fase de un sistema de un solo componente (Lue, 2009).
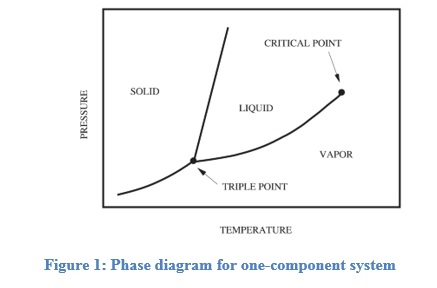
Las curvas que se muestran en la figura representan la coexistencia de dos fases. La curva de fusión es la curva en el diagrama de fase a lo largo de la cual la fase sólida y líquida de un sistema se mantiene en equilibrio. La fase líquida y gaseosa de un sistema permanece en equilibrio a lo largo de la curva de vaporización, mientras que la curva de sublimación representa la etapa de equilibrio entre la fase sólida y la fase gaseosa. El punto triple es el punto en la gráfica donde los tres estados coexisten y es único para cada componente. Si α y β son dos fases cualquiera en las que puede existir un componente, utilizando la primera y la segunda ley de la termodinámica, la pendiente de cualquiera de las curvas en la figura 1 puede representarse por
donde P y T son la presión y la temperatura del componente, respectivamente. ΔS y ΔV son los cambios en la entropía molar y el volumen molar, respectivamente, del componente cuando cambia su fase de α a β en equilibrio.
La ecuación (1) también se puede escribir como donde C es el número de componentes no reactivos en un sistema y n es el número de fases. Por ejemplo, para sistemas de dos componentes y dos fases hay dos grados de libertad intensivos, es decir, temperatura, presión o fracción molar. En otras palabras, en el caso de un sistema de dos componentes y dos fases en equilibrio, solo se necesitan dos variables intensivas para determinar de forma única el estado termodinámico del sistema.
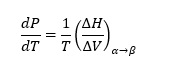
(2)
y se conoce como ecuación de Clausius Clapeyron. La presión de vapor en equilibrio significa que el número de moléculas que se evaporan es igual al número de moléculas que se condensan en la superficie del agua. De acuerdo con la regla de fases de Gibbs sobre los sistemas de componentes múltiples, el número de grados de libertad intensivos en un sistema de componentes múltiples no reactivos (F) en equilibrio se obtiene por![]() (3)
(3)
Existen diferentes tipos de equilibrio que se estudian en detalle: equilibrio líquido-vapor, equilibrio líquido-líquido, equilibrio sólido-líquido, equilibrio sólido-sólido (aleaciones o formas alotrópicas), etc. El aumento en el número de componentes, reacciones químicas, presencia de surfactantes y desviación del comportamiento ideal son algunas de las causas del incremento de la complejidad de los diagramas de fase. Aquí, hemos discutido un caso especial de equilibrio vapor-líquido que se utiliza comúnmente en destilerías, es decir, mezclas de etanol-agua.
Equilibrio vapor-líquido
La ley de Raoult establece que la presión de vapor parcial ejercida por un componente en una solución ideal es el producto de su fracción molar y la presión de vapor del componente puro. De este modo, la presión de vapor total ejercida por una solución ideal con k componentes (P) se obtiene por
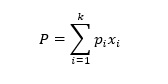 (4)
(4)
donde pi es la presión de vapor del componente puro y xi es la fracción molar correspondiente. Por ejemplo, si en una solución de salmuera (mezcla de dos componentes), un componente (sal común) tiene vapor insignificante a la temperatura especificada, por lo tanto, la presión de vapor de la mezcla es simplemente producto de la fracción molar del agua y la presión de vapor del agua a la temperatura especificada. La ley de Raoult solo es válida para soluciones ideales que no suponen una interacción intermolecular entre diferentes componentes, mientras que en la mayoría de los casos abordados en las industrias casi no hay soluciones ideales. La ley de Raoult modificada se utiliza para soluciones no ideales (J.M. Smith, 2005); en consecuencia la presión total ejercida, P se expresa como
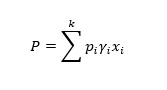 (5)
(5)
donde yi es el coeficiente de actividad para el componente i.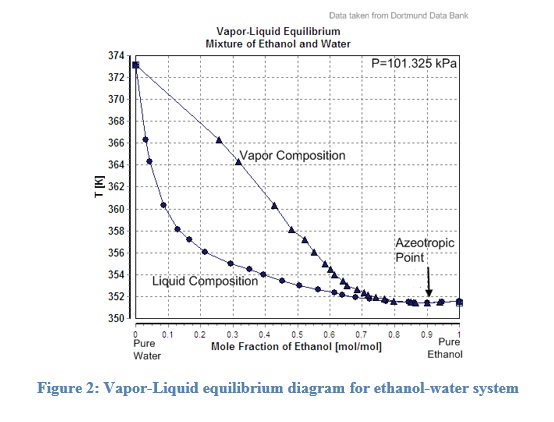
Figura 2: Diagrama de equilibrio vapor-líquido para un sistema de etanol-agua.
La Figura 2 muestra el diagrama de fase para mezclas de etanol-agua (Base de Datos Dortmund). Se utilizan gráficas similares en las destilerías para calcular las temperaturas deseadas para composiciones de salida específicas. Contiene una curva de vapor y una curva de líquido que se utiliza para estimar las composiciones de vapor o líquido. La curva de vapor también se denomina curva de punto de rocío, mientras que la curva de líquido también se denomina curva de punto de burbuja. Curiosamente, las curvas se encuentran en su punto más bajo, lo que sugiere que si una mezcla de etanol y agua se hierve aún más, tendrá la misma composición en la fase de vapor. Por lo tanto, la concentración máxima de etanol obtenida por un proceso de destilación simple en una mezcla de etanol-agua sería del 95.5%. Estas mezclas que tienen el punto de ebullición más alto/más bajo en el diagrama de fase y no pueden ser purificadas aún más se llaman azeótropos. Los azeótropos tienen un punto de ebullición más alto o más bajo que cualquiera de sus componentes, dependiendo de si las mezclas tienen una desviación positiva o negativa de la ley de Roult, respectivamente. En el caso de sistemas de tres componentes o de tres fases, se utilizan gráficas triangulares con tres puntos finales de triángulo que representan los tres componentes puros (fases).
Referencias
Base de Datos Dortmund.
J.M. Smith, H. V. (2005). Introducción a la termodinámica en ingeniería química. Nueva York: McGraw Hill.
Lue, L. (2009). Termodinámica química. Leo Lue & Ventus publishing APS.